El primer paso para tratar cualquier enfermedad es determinar qué es lo que la causa. Es necesario responder a muchas preguntas para comprender lo que se necesita para buscar nuevos tipos de tratamientos.
- ¿Cómo contrae una persona la enfermedad?
- ¿Qué células se ven afectadas?
- ¿Está causada la enfermedad por factores genéticos? Y en ese caso, ¿qué genes están activados o desactivados en las células enfermas?
- ¿Qué proteínas están presentes o ausentes en las células enfermas en comparación con las células sanas?
- Si la enfermedad es causada por una infección, ¿cómo interactúa el microorganismo infeccioso con el organismo?
En los laboratorios modernos se utilizan herramientas sofisticadas para responder a estas preguntas. Las herramientas están diseñadas para descubrir las raíces moleculares de las enfermedades y destacar las diferencias fundamentales entre las células sanas y las enfermas. Los investigadores utilizan con frecuencia varios enfoques para crear una imagen detallada del proceso de la enfermedad.
Una vez que empieza a aparecer la imagen, pueden pasar años hasta saber cuáles de los cambios asociados con la enfermedad son los más importantes. ¿Es el cambio el resultado de la enfermedad o es la enfermedad el resultado del cambio? Al determinar qué defectos moleculares están realmente detrás de una enfermedad, los investigadores pueden identificar las mejores dianas para nuevos medicamentos. En algunos casos, es posible que ya exista un medicamento dirigido contra la mejor diana de la enfermedad, y el objetivo sería desarrollar un nuevo fármaco que conlleve otras ventajas. Con frecuencia, sin embargo, el objetivo del descubrimiento de fármacos es ofrecer un tipo de tratamiento totalmente nuevo que actúe sobre una nueva diana.
Modelos para estudiar enfermedades
Las siguientes herramientas ayudan a los investigadores a obtener información sobre cómo se desarrolla una enfermedad.
Cultivos celulares. Mediante el cultivo de células tanto sanas como enfermas, los investigadores pueden estudiar las diferencias en los procesos celulares y en la expresión de proteínas.
Estudios en especies cruzadas. Los genes y las proteínas presentes en los seres humanos también pueden encontrarse en otras especies. Las funciones de muchos genes humanos se han descubierto al estudiar genes paralelos en otros organismos.
Bioinformática. La comunidad científica genera enormes volúmenes de datos biológicos cada día. La bioinformática ayuda a organizar esos datos para formar una imagen más clara de la actividad de las células normales y enfermas.
Marcadores biológicos. Son sustancias (con frecuencia proteínas) que pueden utilizarse para medir una función biológica, identificar un proceso patológico o determinar las respuestas a un tratamiento. También pueden utilizarse para el diagnóstico, el pronóstico y como guía para el tratamiento.
Proteómica. La proteómica es el estudio de la actividad de las proteínas en una célula, un tejido o un organismo determinados. Los cambios en la actividad de las proteínas pueden arrojar luz sobre el proceso de la enfermedad y el efecto de los medicamentos que se están investigando.

Selección de una diana
El término diana se refiere a la molécula específica del organismo sobre la que un medicamento está diseñado para actuar. Por ejemplo, los antibióticos actúan sobre proteínas
específicas que no están presentes en los seres humanos, pero que son esenciales para la supervivencia de las bacterias. Muchos medicamentos para reducir el colesterol actúan sobre las enzimas que utiliza el organismo para producir colesterol.
Los científicos calculan que existen aproximadamente 8,000 dianas terapéuticas que podrían ser la base para nuevos medicamentos. La mayoría son proteínas de distintos tipos, como enzimas, factores de crecimiento, receptores celulares y moléculas mediadoras de señales celulares. Algunas dianas están presentes en exceso durante la enfermedad, por lo que el objetivo es bloquear su actividad. Esto puede hacerse mediante un medicamento que se una a la diana y evite que interactúe con otras moléculas del organismo. En otros casos, existe una deficiencia o una carencia de la proteína diana, y el objetivo es aumentarla o reemplazarla con el fin de restablecer la función sana. La biotecnología ha permitido crear tratamientos similares o idénticos a las moléculas complejas de las que el cuerpo depende para mantenerse sano.
La increíble complejidad de la biología humana hace muy difícil elegir las dianas adecuadas. Pueden ser necesarios muchos años de investigación y ensayos clínicos para descubrir que una nueva diana no produce los resultados deseados. Para reducir ese riesgo, los científicos intentan demostrar el valor de las dianas a través de experimentos de investigación que muestran la función de la diana en el proceso de la enfermedad. El objetivo es demostrar que la actividad de la diana es la responsable del curso de la enfermedad.

Desarrollo del fármaco
Una vez que se ha identificado un fármaco candidato prometedor, debe someterse a gran cantidad de pruebas antes de que sea posible estudiarlo en seres humanos. Se llevan a cabo un gran número de estudios de seguridad con líneas celulares genéticamente modificadas para que expresen genes que con frecuencia son responsables de los efectos secundarios. El uso de modelos con líneas celulares ha permitido reducir la cantidad de animales necesarios para las pruebas y ha ayudado a acelerar el proceso del desarrollo de los fármacos. No obstante, aún es necesario realizar pruebas en animales para cerciorarse de que el fármaco no interfiera con las funciones biológicas complejas que solo se encuentran en las formas de vida superiores.
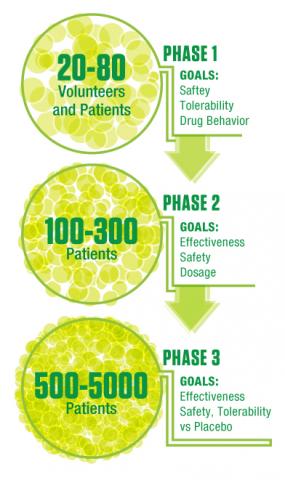
Si el fármaco candidato no presenta problemas importantes de seguridad en los estudios preclínicos, los investigadores pueden solicitar la autorización de las autoridades de salud para realizar ensayos clínicos en seres humanos. La investigación clínica tiene tres fases, y el fármaco debe satisfacer los criterios de éxito en cada una de ellas antes de pasar a la siguiente.
Fase 1. Pruebas en 20 a 80 voluntarios sanos y, en ocasiones, pacientes. Los objetivos principales son evaluar la seguridad y la tolerabilidad, y explorar cómo se comporta el fármaco en el organismo (cuánto tiempo permanece en el organismo, qué cantidad de fármaco alcanza la diana, etc.).
Fase 2. Estudios en aproximadamente 100 a 300 pacientes. Los objetivos son evaluar si el fármaco parece ser eficaz, seguir investigando su seguridad y determinar la dosis óptima.
Fase 3. Estudios a gran escala con 500 a 5,000 pacientes o más, en función de la enfermedad y del diseño del estudio. Con frecuencia se necesitan ensayos muy grandes para determinar si un fármaco puede evitar resultados nocivos para la salud. El objetivo es comparar la eficacia, la seguridad y la tolerabilidad del fármaco candidato con las de otro fármaco o con un placebo.